rRNA配列を用いた魚種判別、系統樹解析
サンガーシーケンスのデータを開いて、データベースで相同性検索を行い、肉片の魚種を推定する。さらにシーケンスした配列を含めた魚類の系統樹を作成する。
サンプルリスト
| ファイル名 | 注釈 |
| 1 | しらす(茨城産)F |
| 2 | しらす(茨城産)R |
| 3 | イワシ(銚子産)F |
| 4 | イワシ(銚子産)R |
| 5 | マダイ(三重産)F |
| 6 | マダイ(三重産)R |
| 7 | サンマF |
| 8 | サンマR |
| 9 | かきあげF |
| 10 | かきあげR |
| 11 | かまぼこF |
| 12 | かまぼこR |
| 13 | はんぺんF |
| 14 | はんぺんR |
| 15 | ほっけF |
| 16 | ほっけR |
| 17 | いくらF |
| 18 | いくらR |
| 19 | サーモンF |
| 20 | サーモンR |
| 21 | ツナマヨF |
| 22 | ツナマヨR |
| 23 | パンガシウスF |
| 24 | パンガシウスR |
| 25 | ビンチョウマグロF |
| 26 | ビンチョウマグロR |
| 27 | イカF |
| 28 | タコF |
| 29 | ブリF |
| 30 | カツオF |
| 31 | タコ小判(おでん)F |
| 32 | イカR |
| 33 | タコR |
| 34 | ブリR |
| 35 | カツオR |
| 36 | タコ小判(おでん)R |
製品の写真
PCR結果
A. サンガーシーケンス配列解析、および系統樹作成のプログラムであるGeneiousの体験版をインストール
1.ウェブブラウザを開く。
2.Geneiousのインストールファイルをダウンロードする。下記のページの「Download…」ボタンをクリックします。(スクリーンショットはMacの場合です。)
https://www.geneious.com/download/
3.ダウンロードが完了したらダウンロードしたファイルをクリックして開きます。(ブラウザ上で見当たらなければ、Windowsならエクスプローラー(Explorer)、MacならFinderを開いて、ダウンロード(Downloads)フォルダを開きます。)
4.Geneiousのインストーラが起動するのでインストーラーに従ってインストールを行います。(下の画面はAgreeをクリック)
5.Macの場合は「Geneious Prime」のアイコンをアプリケーションフォルダにドラッグ&ドロップしてGeneiousをインストールします。
WindowsやLinuxの場合は下記のようなインストーラーが出るので、インストールします。
6.Geneiousを起動します。(Windowsなら画面下のスタートボタンからGeneiousを起動、MacならアプリケーションフォルダからGeneiousを起動)
7.Macの場合は開いても良いか聞かれるので「開く」を押す。
6.「Trial Later」をクリックします。
B. データベースで相同性検索を行う
1.下記のzipデータをダウンロードし、アーカイブマネージャーで開いて、「展開」をクリックし、適当な場所にファイルを解凍する(OSによって操作は多少違います)。とりあえず使うのは各自担当したサンプルのフォワードとリバースのシーケンスデータですが、自分の番号のデータがない人は他のデータを使ってください。
(右クリックして「名前を付けて保存」を選ばないとChromeではダウンロードできません。)
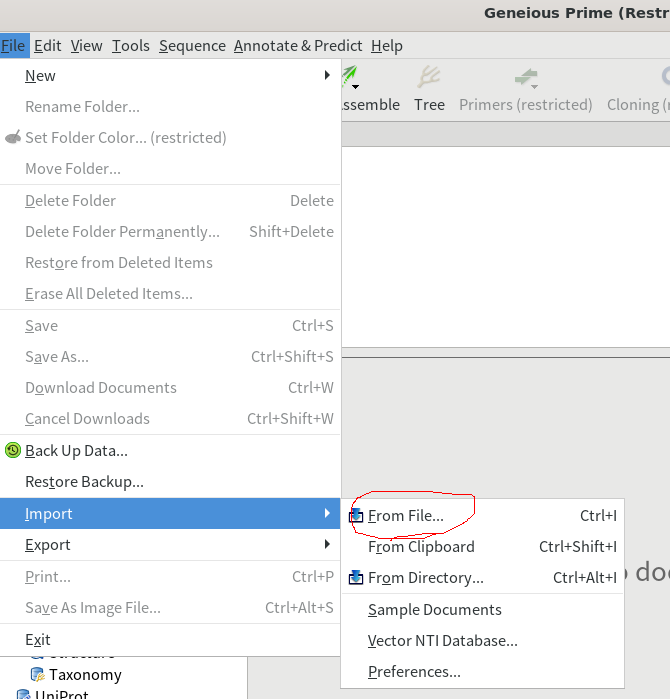
2.Geneiousでシーケンスファイルを開く。「Sources」をLocalなど適当な場所を選択しておいて、「File」→「Import」→「From File…」をクリックし、先ほど解凍したシーケンスファイルを選択して、「Import」をクリックする。
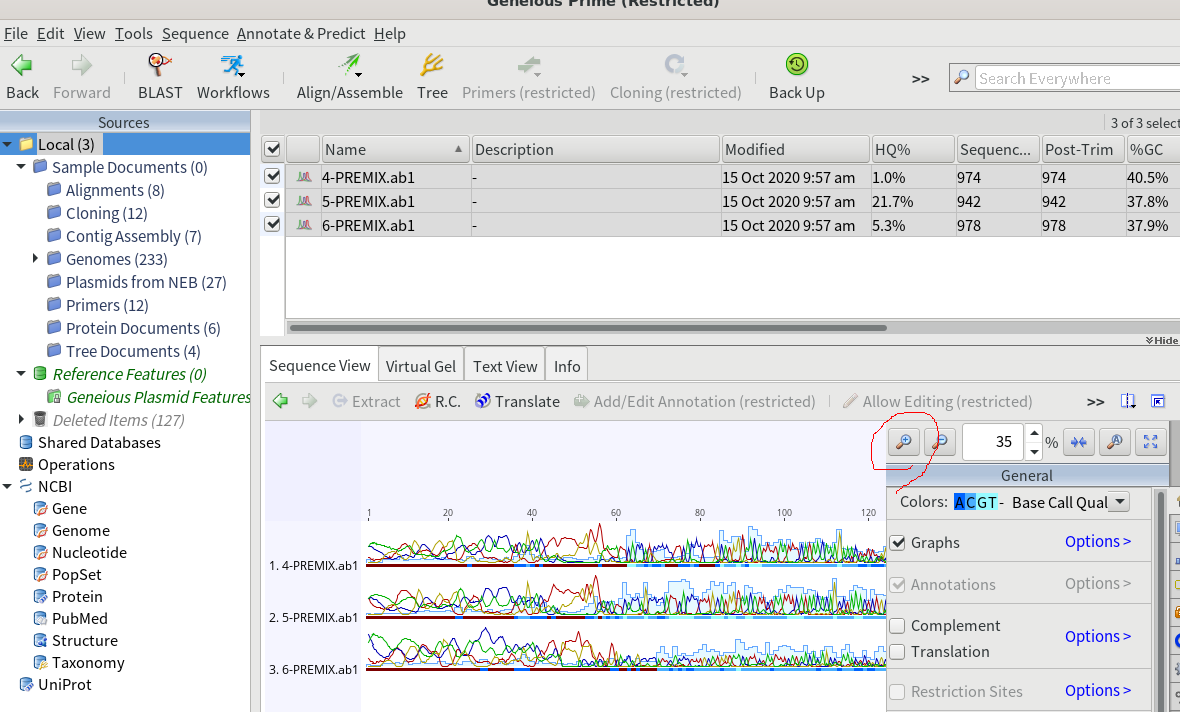
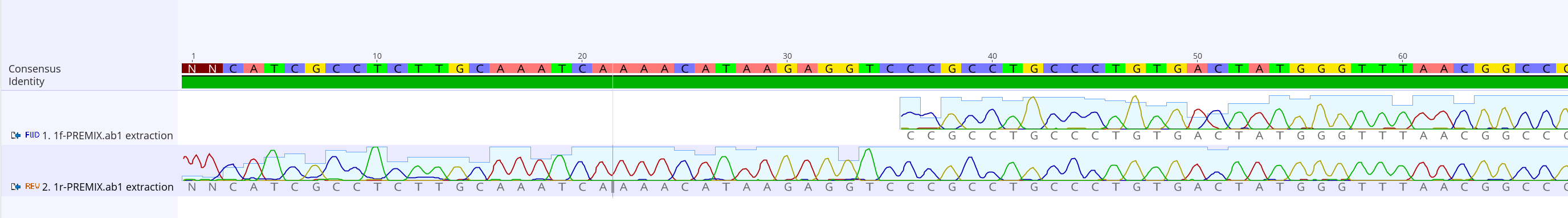
3.拡大すると、サンガーシーケンスの波形を見ることが出来る。
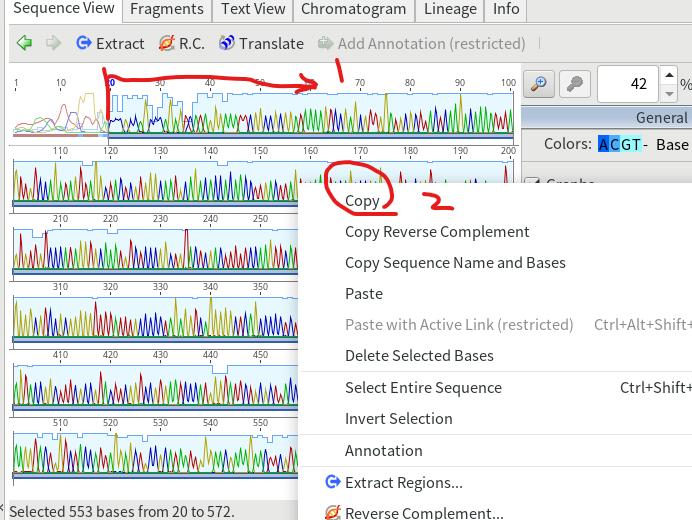
4.綺麗に読めた部分だけ抜き出して、別ファイルに保存する。まずは綺麗に読めた部分をドラッグ&ドロップで選択し、右クリックしてコピーを選択する。
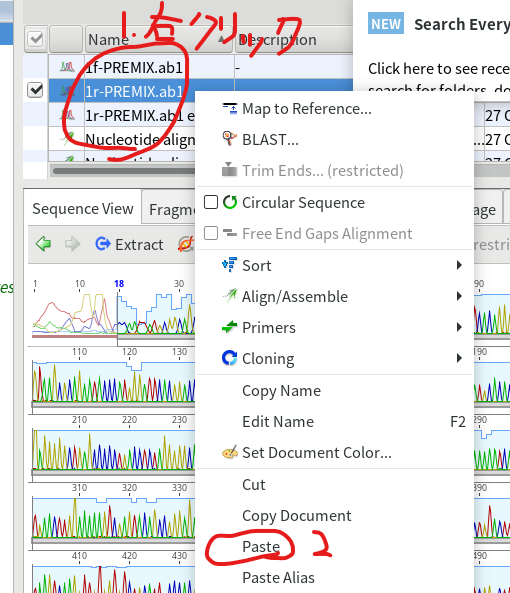
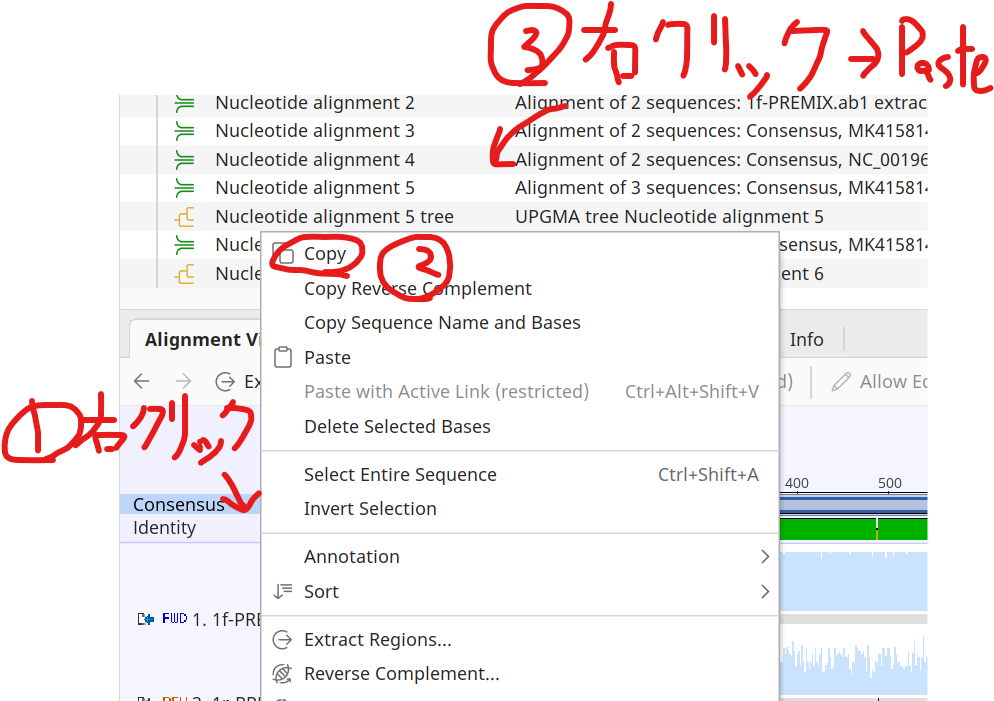
5.リストの適当なところで右クリックして、Pasteを押す。
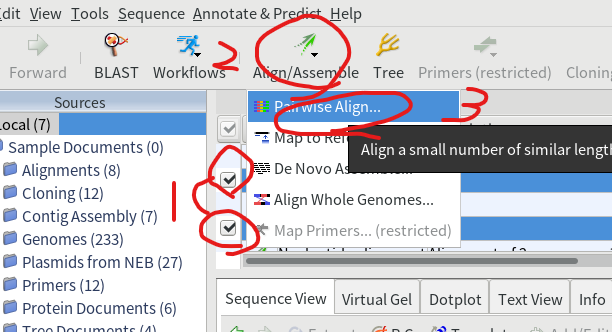
6.フォワードとリバースで抜きだした配列を選択し、アライメントを実行する。
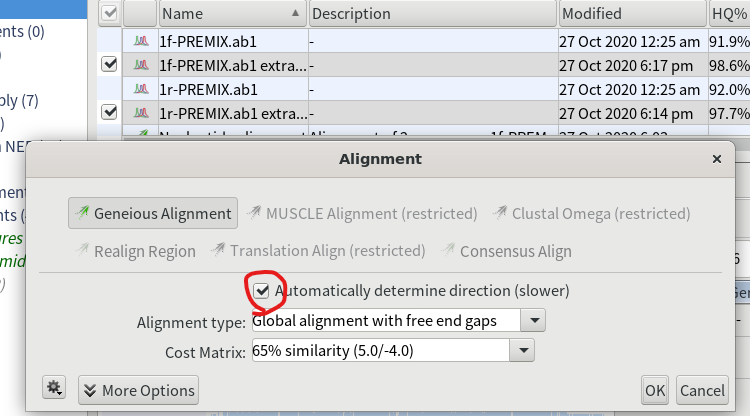
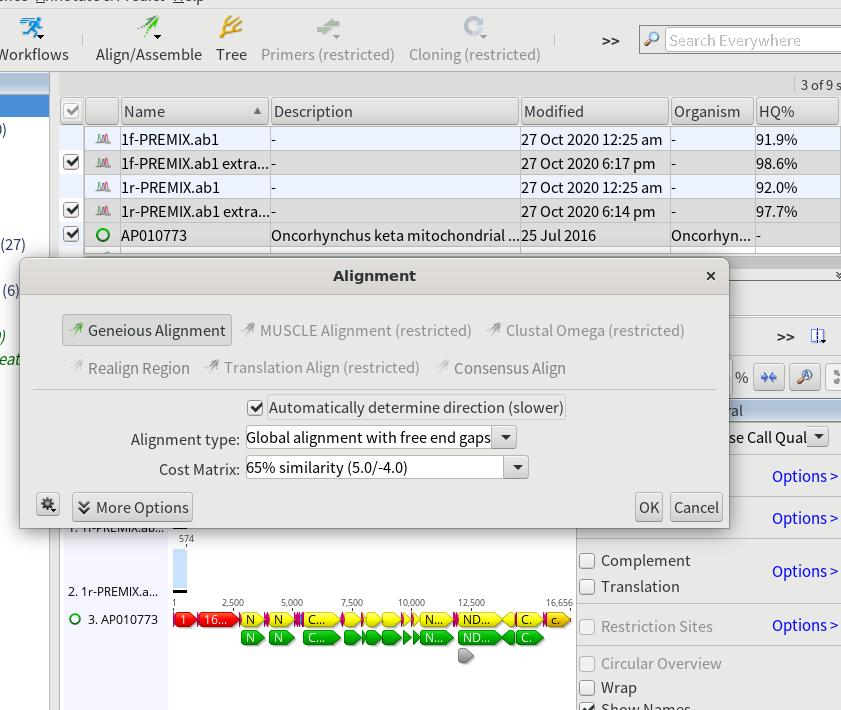
7.自動で配列の向きを合わせてくれるように「Automatically determine direction (slower)」にチェックを入れておく。
8.下記のプライマー配列がコンセンサス配列の両端に出現するか確認してみる。
16SarL(フォワード) CGCCTGTTTATCAAAAACAT 16SbrH(リバース) CCGGTCTGAACTCAGATCACGT
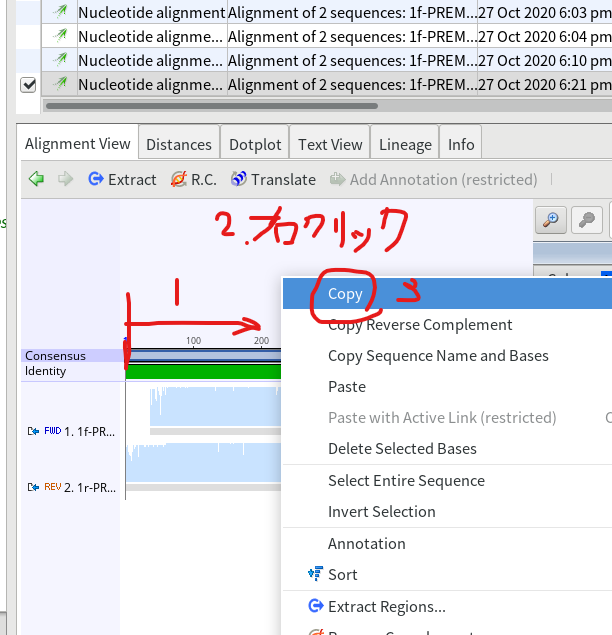
9.Consensus配列をドラッグ&ドロップで選択し、右クリックしてCopyする。
10.下記のNCBI BLASTのページを開いて、「nucleotide → nucleotide」(通称blastn)を開いて、コピーした配列をクエリーに張り付ける。Databaseにnr/ntが選択されていることを確認して、BLASTをクリックする。nr/ntはGenbankに登録された配列の冗長さを除去した(non-redundantな)データベースで、幅広い生物種・遺伝子が網羅的にバランスよく登録されていて、まずはここで配列を検索する研究者が多い。
https://blast.ncbi.nlm.nih.gov/Blast.cgi
11.そのほか、魚類のミトコンドリア専用のデータベースとして、東大岩崎研でメンテナンスされているMitoFishデータベースがある。こちらは2022年11月現在、3,492種の魚の完全長のミトコンドリアが登録されており、BLAST検索が可能である。NCBI NTデータベースと、MitoFishデータベース両方で検索して違いを比較してみる。
http://mitofish.aori.u-tokyo.ac.jp/
12.ミトコンドリアの配列をデータベースからダウンロードし、シーケンスデータとアライメントを行い、シーケンスした領域がどこだったのか確認する。
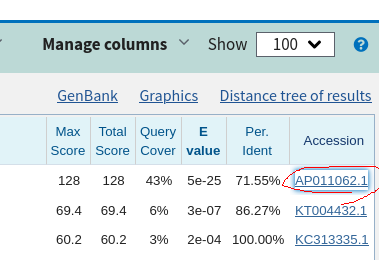
NCBI、MitoFishどちらも結果を適当にクリックしていると、ヒットした配列のAccession番号のリンクを見つけることが出来るはず。Accession番号を開くと、GenBankに登録されている配列をアノテーション付きで表示することが可能である。
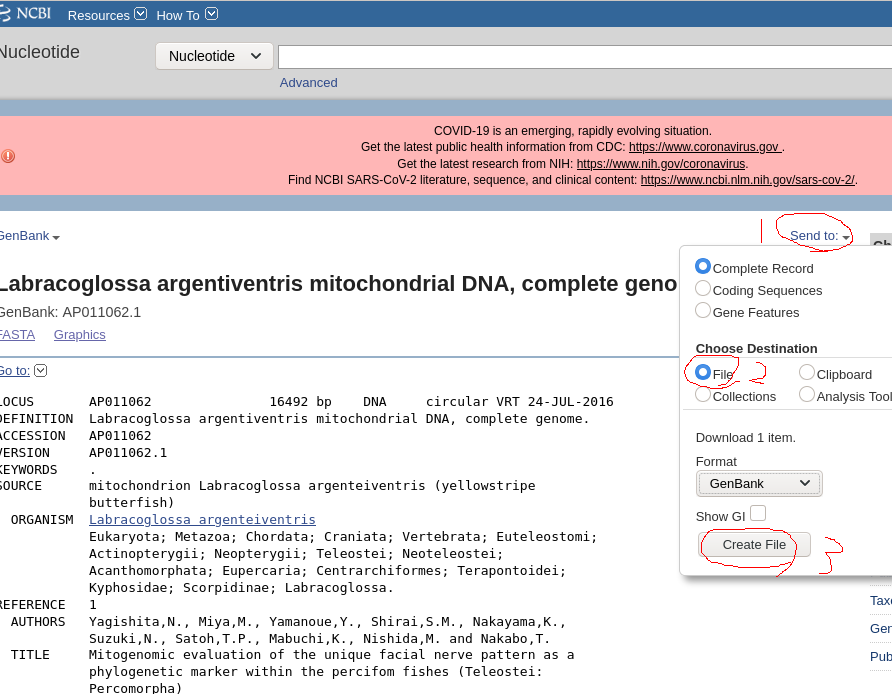
13.シーケンスデータと相同性のある完全長ミトコンドリアの配列をGenBankで開き、GenBank形式でファイルに保存するを選んでダウンロードする。
14.Geneiousで「File」→「Import」→「From File…」をクリックし、先ほどダウンロードしたGenBankファイルを開く。
15.シーケンスデータと、インポートしたGenBankファイルを選択し、「Align/Assemble」→「Multiple Align…」をクリックする。「Automatically determine direction (slower)」にチェックを入れて「OK」を押す。
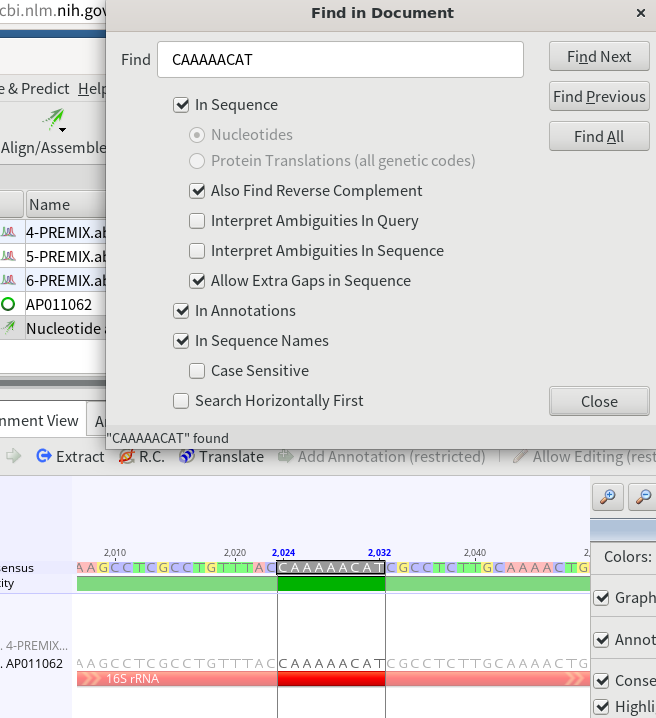
16.Alignment ViewでCtrl+Fを押すと、配列を検索する画面が開くので、下記のプライマーの配列を張り付けて検索してみる。もしヒットしない場合は、プライマーの配列が保存されていない可能性もあるため、適当に検索する配列を短くしてヒットするかどうかを見ていく。ヒットする配列は基本的には16S rRNAの中にあるはずである。
16SarL(フォワード) CGCCTGTTTATCAAAAACAT 16SbrH(リバース) CCGGTCTGAACTCAGATCACGT
17.プライマーの配列から何塩基くらい離れたところからシーケンスが開始されているか、シーケンスデータとリファレンス配列が不一致な場所があれば、波形が綺麗に読まれているかどうかを確認する。
自分の担当したサンプル番号とBLASTの結果を、紙に書き込んでTAに提出する。
C. 系統樹作成
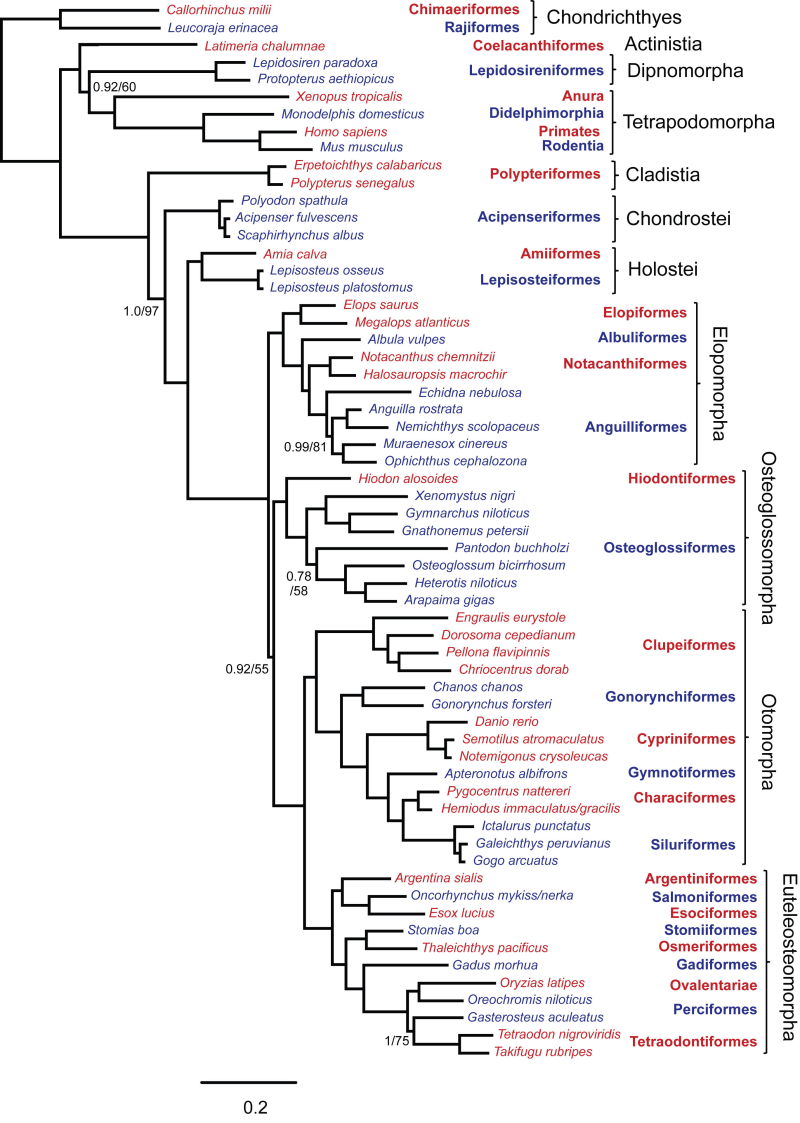
ミトコンドリア16S rRNAによる魚類の系統樹を作成し、魚類の中での系統関係を解析する。
1.サンガーシーケンスで得られたフォワードとリバースのコンセンサス配列を新しいレコードに保存しておく。
2.下記のファイルには46種の生物のミトコンドリア16S rRNA配列が含まれているのでダウンロードする。
http://suikou.fs.a.u-tokyo.ac.jp/yosh_data/2020jissyu/16S-46sp.fasta.zip
3.Geneiousの「File」→「Import」→「From File…」からダウンロードしたファイルを開く。その際、「Nucleotide sequences」→「Keep sequences separate」を選んでおく。
4.各自担当した魚肉の配列と、追加した46種の配列を全て選択して、「Align/Assemble」→「Multiple Align…」をクリックし、マルチプルアライメントを作成する。(しばらく時間がかかる。)
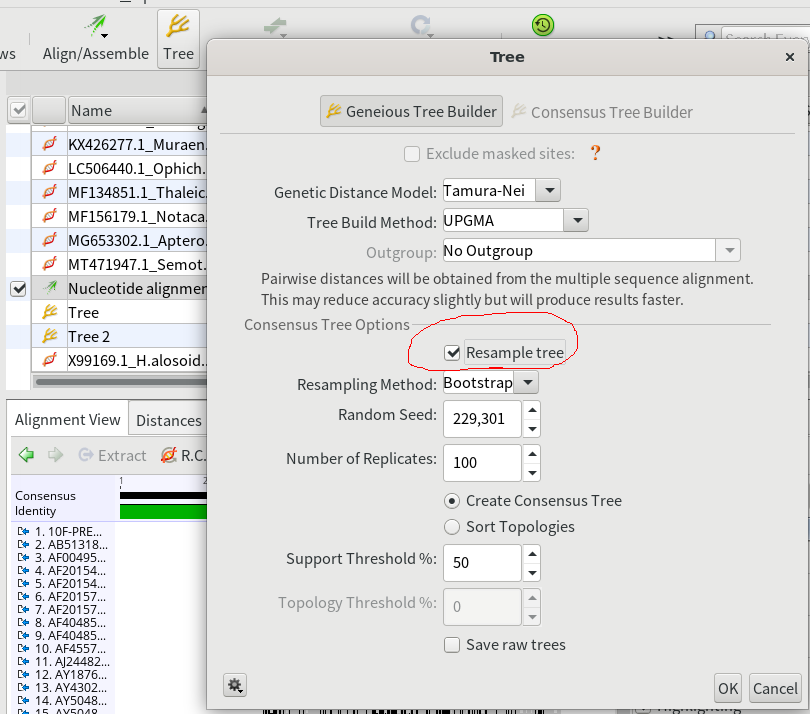
5.マルチプルアライメント結果を選択した状態で、「Tree」をクリックし、UPGMAによる系統樹を作成する。その際各分岐の確からしさをブートストラップ法によって求めるため、「Resample tree」にチェックを入れて「OK」を押す。
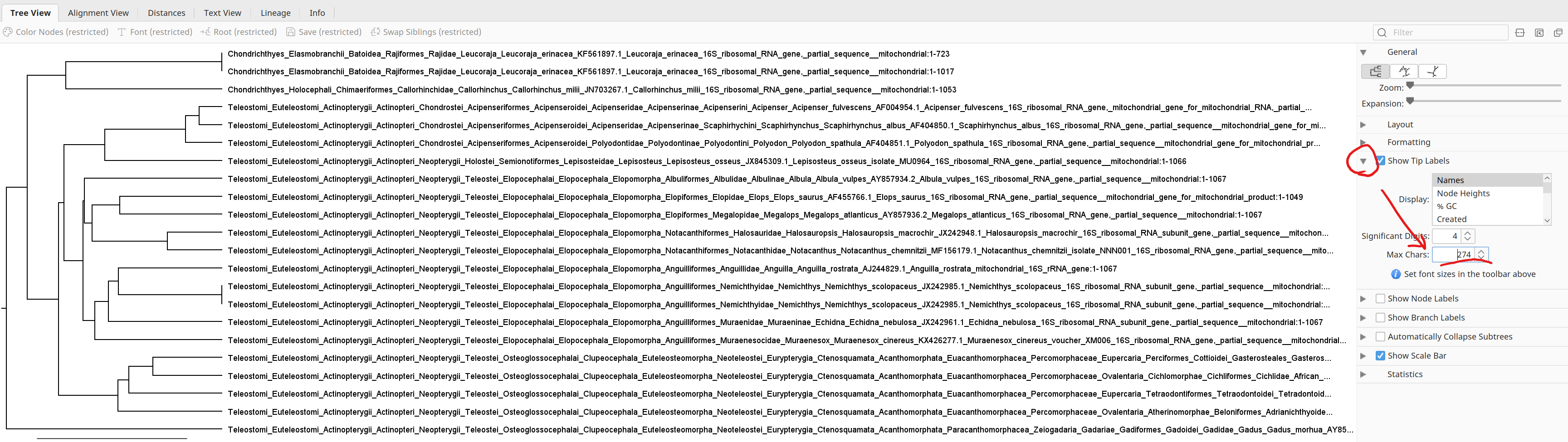
6.作成された系統樹には、大分類群から分類名が書かれているため、そのままでは見えづらいので、Tip Labelsを開いて、Max Charsを30→200などに変更して分類名を表示してみる。そうすると、「Chondrichthyes(軟骨魚綱)」と硬骨魚類の属する「Teleostomi(真口亜綱)」で分かれているのが見られるはず。
7.Genbankに登録された配列の中から、興味のある魚種のミトコンドリア16Sを抽出してGeneiousに取り込み、系統樹を作成する。
https://www.ncbi.nlm.nih.gov/nucleotide/
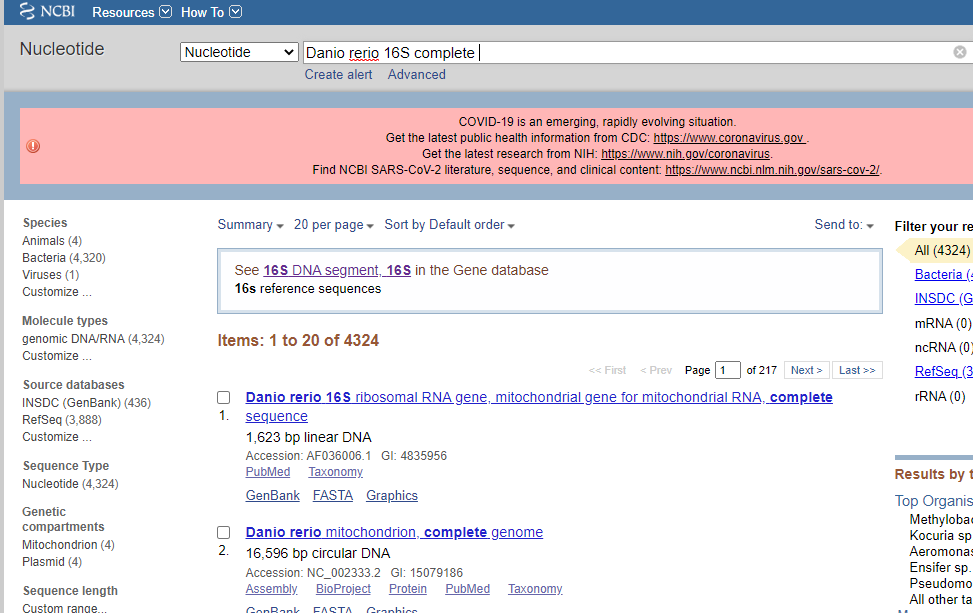
例えばゼブラフィッシュの16Sを探す場合は、「Danio rerio 16S complete」などで検索してみると良い。
8.Genbankからダウンロードした配列をそのまま使うと、配列の長さが異なり変な系統樹になってしまうので、サンガーシーケンスで得られた配列とアライメントが取れる領域のみを抜き出してから、上記4.のステップに新しく配列を追加する。
追加する配列としては、BLASTでトップヒットした魚種の16Sや、例えばBLASTで日本近海に棲息していない魚がトップヒットした場合などは日本近海の近縁種の配列などを試してほしい。
既知の系統樹の例:
D. 検討項目の例
- プライマーの配列から何塩基くらい離れたところからシーケンスが開始されているか。
- NCBI NTデータベースとMitoFishデータベースの相同性検索結果に違いはあったか。どちらが望ましい結果だったか。
- BLASTでヒットしたトップヒットの種や近縁種の配列をGenbankからダウンロードして系統樹に追加してみると期待したとおりになったか。